Qu’elle soit naturelle ou de culture (fabriquée), la neige se fonde sur des phénomènes physicochimiques inhérents aux changements de phases appliqués à la molécule d’eau. Les trois principaux phénomènes à l’œuvre dans la solidification de la vapeur d’eau (nuages) et de l’eau à l’état liquide (glace) sont la surfusion, la nucléation et la cristallisation.
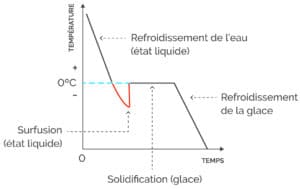
La surfusion représente l’état latent du processus de solidification. En théorie, l’eau se solidifie à 0ºC. Toutefois, pour passer de l’état liquide à l’état solide, les molécules d’eau doivent amorcer leur métamorphose par la nucléation, processus par lequel les molécules sont soumises à une réaction en chaîne où graduellement elles s’agglutinent les unes aux autres sous une forme polycristalline. Cette dernière transformation se nomme cristallisation.
À l’état de surfusion, la température de l’eau peut descendre jusqu’à -40ºC. Le degré de pureté influe positivement sur le maintien de l’eau en surfusion. Cela s’explique par une énergie interne latente (état de métastabilité) ne pouvant amorcer à elle seule la réaction en chaîne de nucléation. Toutefois, la moindre perturbation (ex. : secousse, contact avec un solide) déstabilise cet état latent et une solidification presque instantanée s’ensuit.
Graphique illustrant le passage de l’eau de son état liquide à l’état solide au contact d’une paroi
À ce stade, tout contact de l’eau liquide ou la vapeur avec une surface physique ou toute impureté comme de la poussière, du sable ou des particules de glace devient un germe de nucléation. Attirées par ces substances, les molécules d’eau se transforment presque instantanément en cristaux de neige ou glace. Ce type de nucléation est qualifiée d’hétérogène par opposition à la nucléation homogène, où les molécules (très purifiées) amorcent leur phase de cristallisation à leur température de solidification (-40ºC) sans apport de germes externes.
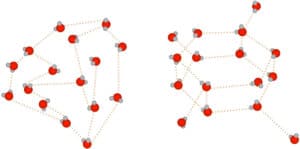
Noyaux de nucléation se formant dans la vapeur d’eau

Le réarrangement des molécules d’eau (devenue glace) ne s’effectue pas de manière aléatoire. Le processus de cristallisation de l’eau se matérialise selon une structure particulière : polycristalline à six facettes. Les cristaux de neige naturelle permettent l’observation tangible de ce phénomène. Cette structure hexagonale est toutefois difficile à distinguer à l’œil nu dans la neige de culture, se trouvant imbriquée dans les minuscules grains arrondis.
Formation d’un cristal de glace à partir de molécules liquides d’eau